Актуальность измерения концентрации хлора
ХЛОР (лат. Chlorum), Cl – химический элемент VII группы периодической системы Менделеева, атомный номер 17, атомная масса 35,453; относится к семейству галогенов. При нормальных условиях (0 °С, 0,1 Мн/м 2) жёлто-зелёный газ с резким раздражающим запахом. Природный хлор состоит из двух стабильных изотопов: 35Cl (75,77%) и 37Cl (24,23%). Искусственно получены радиоактrивные изотопы с массовыми числами 32, 33, 34, 36, 38, 39, 40 и периодами полураспада Т1/2 соответственно 0,31; 2,5; 1,56 сек; 3,1*105 лет; 37,3; 55,5 и 1,4 мин. 36Cl и 38Cl используются как изотопные индикаторы.
Хлор является одним из биогенных элементов и неотъемлемых компонентов тканей растений и животных, несмотря на то, что содержание его в живых организмах предельно мало. Потребность человека в хлоре покрывается за счет продуктов питания, в основном в виде хлорида натрия и хлорида калия. В организме хлор является осмотически активным веществом плазмы лимфы, крови, спинномозговой жидкости, а также принимает непосредственное участие в водно-солевом обмене и способствует удержанию воды в тканях. Однако избыток хлора весьма опасен для здоровья. Максимальная концентрация хлора в воздухе производств, помещений не должна превышать 1 мг/м3. Производство любых хлоросодержащих соединений относится к производствам с вредными условиями труда.
В растительном мире значение хлора не менее велико – хлор позитивно воздействует на поглощения корнями кислорода и необходим для его образования в процессе фотосинтеза. В малых дозах хлор способствует развитию растений. Разработаны специальные механизмы и приборы для измерения контроля концентрации хлора в растворах, в частности, и воде.
Контроль за концентрацией хлора и его производных имеет важное значение для управления процессом обеззараживания питьевых и сточных вод. Для контроля концентрации хлора применяют специальные анализаторы, принцип действия которых предельно прост: имеется чувствительный элемент (электрод), реагирующий на хлор и его производные. В результате электрохимические реакций в чувствительном элементе возникает ток определенной величины. С нагрузочного резистора снимается выходное сопротивление, которое посредством АЦП преобразуется в унифицированный цифровой сигнал. Не составляет никаких трудностей передавать такой сигнал на устройства отображения и индикации, либо на контроллер.
Существуют также приборы (концентратомеры), способные определять концентрацию хлора на основе полярографического метода измерения. В основе принципа лежит измерение силы тока на поляризованном ртутном электроде, значения которого однозначно связано с концентрацией хлора в растворе.
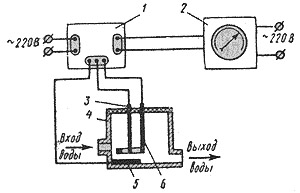
Схема автоматического анализатора остаточного хлора: 1 - входной блок; 2 - вторичный показывающий и записывающий прибор типа ЭПД; 3 - вспомогательный электрод; 4 - корпус электродной ячейки датчика; 5 - положительный ртутный электрод; 6 отрицательный кольцевой электрод.
Вода поступает в электродную ячейку, состоящую из ртутного положительного и отрицательного (из нержавеющей стали) электрода, также вспомогательного каломельного ртутного электрода (он находится в непосредственной близости от ртутного электрода и служит для поддержания постоянства потенциала используемого для измерения электрода). Для поддержания необходимого значения потенциала используют также потенциостат. Такие анализаторы концентрации способны измерять концентрацию всего, в том числе и связанного хлора в растворе.

Роспотребнадзор: питьевая вода в Приморье опасна для населения
В Приморском крае питьевая вода опасна для населения, предупреждает краевое управление Роспотребнадзора. Как говорится в докладе управления, избыток кремния и марганца, дефицит кальция и магния можно рассматривать в качестве потенциальных...
Тесты Смотреть
все тесты

Фильтр убийца.
Простой эксперимент в
домашних условиях.
Сегодня почти в каждом доме можно увидеть бытовые фильтры кассетного типа отечественных и зарубежных производителей. Покупая фильтры и картриджи к ним, мы психологически успокаиваемся в плане проблем с очисткой воды из под крана. А зря!






